
Классификация, взаимосвязь и закономерность — три «слона», на которых зиждутся многие точные и неточные науки, а открытие Дмитрия Менделеева стало вершиной эффективного и доступного метода деления вещей и понятий. Разбираемся в структуре таблицы Менделеева и раскладываем все «по полочкам», чтобы досконально понять, как она устроена и как ей пользоваться.
Что такое периодическая система химических элементов Менделеева
Все, что нас окружает, живое или неживое, состоит из химических элементов, а те — из атомов. От того, как последние устроены, сколько в них частиц (нейтронов и протонов), каков заряд их ядра, зависят свойства элементов, собранных в таблице Менделеева. Она названа именем своего первооткрывателя — Дмитрия Ивановича Менделеева. Именно этот русский ученый 1869 году установил, что свойства элементов и их атомные массы связаны определенной зависимостью, которая и легла в основу периодической таблицы. Интересно, что величайшее научное открытие, совершившее переворот в изучении химии, сделал человек, который был младшим, 17-м по счету ребенком в семье сибирского фабриканта. По словам Олега Писаржевского, написавшего биографическую книгу о Менделееве, ученый работал над таблицей и одноименным законом «почти сорок лет, находя все новые и новые подтверждения своему открытию, уточняя и углубляя его» (1).
История открытия периодического закона
Закон, открытый Менделеевым, устанавливает периодическое изменение свойств химических элементов в зависимости от изменения зарядов атомных ядер. После его появления химия перестала быть наукой описательного характера. Многие химики еще до Менделеева пробовали хоть как-то упорядочить элементы и связать атомную массу со свойствами элементов. Но открыть фундаментальный закон химии удалось только Дмитрию Ивановичу. Случилось это во время написания учебника «Основы химии».
Когда ученый работал над материалом и структурой учебника, он сделал однозначный вывод — между «поведением» веществ и их атомными массами имеется какая-то непонятная закономерность. Но вскоре она была им разгадана. Впрочем, это было не мгновенное озарение сродни «Эврике!» Архимеда. Это был итог многолетних раздумий и изысканий. При этом сам Менделеев любил рассказывать, что идея периодической системы ему просто-напросто приснилась.
Работая над поиском закономерности, в качестве аргумента ученый избрал массу элемента, измеряемую непосредственно атомным весом. Он поставил цель — найти функциональную связь между атомными весами элементов и их особенностями. Свой закон Менделеев изначально решил увязать с такими химическими понятиями, как атом, атомный вес и атомность (валентность) (2).
Рукопись с таблицей, названной впоследствии именем автора, Менделеев сдал в печать 17 февраля 1869 года. Работа называлась «Опыт системы элементов, основанной на их атомном весе и химическом сходстве». Ученый доказал, что свойства элементов по мере роста атомной массы изменяются не плавно, а периодически. На фундаменте проделанной работы Менделеев вскоре вывел периодический закон, на котором и зиждется таблица, вернее, она была ее графическим выражением. Ранее во многих ее клетках была пустота, но Менделеев был твердо убежден, что когда-нибудь они будут заполнены. И не ошибся. Уже спустя 15 лет после формулировки закона были открыты сразу три элемента, в существовании которых был уверен ученый, — Ga, Sc, Ge. Закон работал!
Структура таблицы Менделеева
В таблице имеется множество клеточек, и в каждую вписан один элемент. В ней также легко заметить разделение — на периоды и группы. Все вещества выстроены в строгой последовательности: слева направо идет возрастание роста их атомных масс. Часто в таблице используется цветовая заливка, она помогает ориентироваться в ее структуре и группирует элементы по их свойствам.
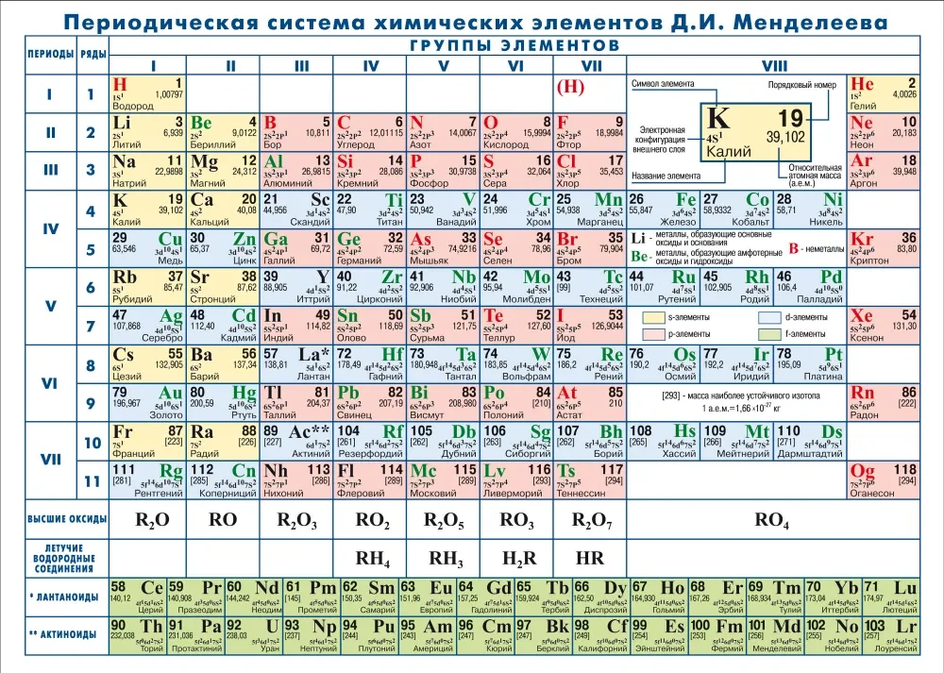
Но почему таблицы Менделеева выглядят по-разному — они бывают цветные и черно-белые, отличаются размерами и обозначениями. С этим вопросом мы обратились к кандидату химических наук, старшему научному сотруднику лаборатории материалов и процессов водородной энергетики Физико-технического института им. А. Ф. Иоффе Кириллу Мартинсону.
— Визуализация таблицы Менделеева зависит от использования различных систем нумерации и классификации элементов, от того, на какие свойства выбирается фокус, — отметил эксперт. — В одних случаях акцентируется внимание на электронных оболочках и распределении электронов, в других — выделяются элементы с особыми свойствами, например благородные газы, переходные металлы или редкоземельные элементы.
По словам нашего собеседника, периодическая таблица по мере развития науки расширялась и дополнялась. Сегодня есть версии с арабскими и римскими цифрами, с разной классификацией элементов, например, по типу орбиталей (s, p, d, f-блоки) или по металлическим и неметаллическим свойствам.
Периоды
Периодами называют горизонтальные строчки. Их всего семь. Элементы, объединенные одним периодом, обладают одинаковым числом энергетических уровней, на которых имеются электроны.
В пределах одного периода, с возрастанием порядкового номера, просматриваются следующие закономерности:
- растет электроотрицательность;
- уменьшаются металлические свойства, а неметаллические растут;
- становится меньше атомный радиус — в таблице есть малые и большие периоды.
В малых периодах содержится мало элементов — это I, II и III периоды. В первом — два элемента, во втором и третьем — по восемь элементов. Остальные периоды большие: в IV и V по 18 элементов, в VI — 32, в VII — 24. Внизу таблицы имеются еще две строчки — с лантаноидами и актиноидами (VI и VII соответственно).
В таблице всего десять рядов, в малых периодах — по одному ряду, в остальных — по два. Из больших — только в VII периоде содержится один ряд.
Группы
Группы расположены вертикально (в столбцах), причем в пределах каждой из них у элементов наблюдаются схожие свойства. С возрастанием атомного числа последние меняются в соответствии с определенной закономерностью. Всего в таблице 18 групп. Отсчет идет с левой стороны направо.
Таблица 1. Группы и подгруппы
| № группы | Название группы/подгруппы (п/г) |
| 1 | щелочные металлы |
| 2 | щелочноземельные металлы |
| 3 | п/г скандия |
| 4 | п/г ванадия |
| 5 | п/г титана |
| 6 | п/г хрома |
| 7 | п/г марганца |
| 8 | п/г железа |
| 9 | п/г кобальта |
| 10 | п/г никеля |
| 11 | п/г меди |
| 12 | п/г цинка |
| 13 | п/г бора |
| 14 | п/г углерода |
| 15 | п/г азота |
| 16 | п/г кислорода |
| 17 | галогены |
| 18 | инертные газы |
Элементы, входящие в одну группу, показывают изменение свойств (если двигаться сверху вниз):
- растет радиус атома;
- металлические свойства становятся более выраженными, а неметаллические, наоборот, слабеют;
- уменьшается электроотрицательность (способность атомов притягивать электроны).
Группы пронумерованы арабскими цифрами, но может быть использована и римская нумерация с добавлением букв А и Б.
Элементы
Во времена Менделеева таблица была далека от полного заполнения. Так, например, ученые не подозревали о наличии благородных (инертных) газов. Правда, незадолго до эпохального открытия стали говорить о каком-то странном элементе: ученые именовали его «солнечный газ». Это был гелий, который открыли почти через 30 лет. Благодаря таблице удалось предвидеть открытие других веществ. Так, сам Менделеев утверждал, что в природе есть эка-алюминий, эка-кремний и эка-бор (3), которые сегодня называются галлий, скандий и германий соответственно.
На сегодня в таблице собрано 118 элементов. В 2000-е годы туда добавили теннессин (№117) и оганесон (№ 118). Сейчас идут активные исследования по поиску 119-го элемента. Он еще не найден, но уже получил название, вернее даже два — унуненний или эка-франций.
Химические элементы от водорода до урана, имеющего 92-й номер (у него 92 протона и столько же электронов), встречаются в природе. Все элементы начиная с нептуния, идущего под 93-м номером, имеют искусственное происхождение: ученые создали их в лабораторных условиях.
Свойства таблицы Менделеева
Периодическая таблица не сразу получила признание, но впоследствии именно благодаря ей Менделеев стал самым известным в мире русским ученым. Уникальная систематизация элементов, представленная в табличном выражении, обладает рядом свойств, позволяющим эффективно пользоваться ею при решении самых разных химических задач.
- Изменение атомного радиуса происходит с определенной закономерностью. Причем в группах и периодах она разная. Во-первых, рост наблюдается сверху вниз, а во-вторых, уменьшение происходит слева направо. На внешнем уровне при этом растет число электронов, они интенсивнее притягиваются к ядру, и атомы будто «сжимаются».
- Закономерное изменение металлических и неметаллических свойств, которое выражается в способности отдавать и захватывать электроны соответственно. Чем более удален электрон от ядра и чем меньше их число на крайней орбите, тем легче происходит отдача. В периодах рост металлических свойств происходит справа налево, а в группах — сверху вниз. С неметаллическими же свойствами все ровно наоборот — в группах усиление идет снизу вверх, а в пределах периодов — с левой стороны направо.
- Изменение основных и кислотных свойств. Первые проявляются у металлов, последние — у неметаллов. Изменение происходит по аналогии со свойствами металлов и неметаллов.
Таблица Менделеева кажется абсолютно уникальным и даже совершенным творением научной мысли. Но Кирилл Мартинсон считает, что некорректно использовать понятие «совершенство» в вопросах, касающихся интерпретации фундаментальных законов природы.
— Периодическая таблица не является статичным и неизменным инструментом, — подчеркивает эксперт, — это динамическая модель, развивающаяся вместе с прогрессом науки. Ученые неоднократно вносили в нее изменения и дополнения, отражая новые открытия и углубленное понимание структуры атомов.
Как правильно читать таблицу Менделеева
В ячейках таблицы находится важная информация об элементах, которые их занимают. Несмотря на краткость, она полностью раскрывает особенности всех веществ и позволяет предвидеть их «поведение» в той или иной ситуации.
В каждой ячейке таблицы представлены:
- Порядковый номер. Он может располагаться вверху, по центру или в углу. Самый маленький номер — 1, самый большой — 118.
- Название. В таблице может указываться полное название вещества или только химический символ, который состоит из 1—2 латинских букв.
- Массовое число. Под ним понимают общее число нейтронов и протонов в атомном ядре. Его легко определяют по атомной массе, округляя до целых чисел. В нижней части клеток — атомная масса (сумма масс протонов и нейтронов). Ее значение представлено обычно как десятичная дробь.
По таблице также легко определяется валентность вещества, отражающая способность элементов образовывать химические связи.
Примеры задач на работу с таблицей Менделеева
Посредством таблицы решают самые разные химические задачи. Рассмотрим пару примеров использования периодической системы Менделеева при решении элементарных заданий.
Задача № 1
Определите, сколько протонов и нейтронов имеется в составе ядра кислорода с массовым числом 18.
Решение:
Смотрим в таблицу Менделеева, находим там кислород. Обычный кислород имеет атомную массу 16. Порядковый номер кислорода — 8, значит, ядро его радиоактивного изотопа, имеющего массовое число 18, содержит 8 протонов и 10 нейтронов.
Задача № 2
Пользуясь периодической таблицей, определите количество нейтронов в ядре бора с массовым числом 11.
Решение:
Количество нейтронов равняется разности массового и зарядового (атомного) числа. Последнее определяется порядковым номером. Смотрим в таблицу, атомный номер бора — 5. Таким образом, количество нейтронов находим как 11 – 5 = 6.

Комментарий эксперта
О существовании таблицы Менделеева знает каждый, кто ходил в школу, при этом одни люди пользуются ею каждый день, другие совершенно не умеют ее «читать». Вместе с тем есть вещи, которые должен знать любой человек, о них мы и поговорили с Кириллом Мартинсоном.
— Человеку, который по сфере своей деятельности не имеет прямого отношения к физике или химии, таблица Менделеева, конечно, не будет приносить прямой практической пользы, — считает эксперт. — Но понимание общих законов природы важно для каждого, поскольку это способствует более осознанному восприятию мира.
Кирилл Мартинсон рассказал, что существуют таблицы Менделеева с различными способами представления периодичности свойств элементов. Встречаются спиральные, круговые или трехмерные версии, позволяющие подчеркнуть определенные свойства элементов или их взаимосвязи.
— Все естественно встречающиеся на Земле элементы уже открыты, но исследования в области синтеза новых сверхтяжелых элементов, которые характеризуются крайне нестабильными ядрами, продолжаются, — констатирует Кирилл Мартинсон. — Они распадаются на другие элементы в течение долей секунды после своего образования. Их синтез требует сложных технологий и высокоэнергетических установок, таких, например, как ускорители частиц.
Вопрос о том, существует ли «последний» элемент, остается открытым:
— Теоретически существование элементов с еще большими атомными номерами возможно, но с увеличением заряда ядра атома уменьшается их стабильность. Существуют особые области в периодической таблице — «острова стабильности», где сверхтяжелые элементы могли бы иметь относительную стабильность, но практическое подтверждение этого пока не достигнуто.
С помощью таблицы Менделеева можно определять базовые характеристики элементов (атомный номер, относительная атомная масса, строение электронных оболочек, количество валентных электронов и т. д.), она также позволяет определить электроотрицательность, энергию ионизации, атомный радиус и другие физико-химические свойства элементов.
Что нужно запомнить о периодической системе химических элементов Менделеева
Периодическая система Менделеева дала мощный импульс развитию химической науки. С ее открытием ученые смогли вести исследования с целью обнаружения новых элементов и выявления ранее неизвестных свойств. Таблица установила закономерность и связи между элементами и их свойствами. Она способствовала обнаружению элементов, о существовании которых ранее ученые даже не подозревали.
1. В периодах/группах характеристики элементов меняются в определенной закономерности. Увеличиваются или уменьшаются свойства металлического и неметаллического характера, усиливается или ослабевает способность элементов к вступлению в реакции.
2. По положению элемента в таблице/группе/периоде можно установить его принадлежность к металлам/неметаллам, валентность и прочие особенности. Достаточно взглянуть на ячейку и ее положение в таблице, чтобы получить максимум информации об элементе.
3. Периодическая таблица позволяет предсказывать характер химических реакций, в которых будет участвовать элемент. С ее помощью можно многое узнать о реакционных способностях элементов, могут ли они проводить электричество, твердые они или мягкие, и многое другое.
Список источников:
- Писаржевский О. Дмитрий Иванович Менделеев. 1949.
- Семишин В. Периодический закон Менделеева в работах русских ученых. 1959.
- Белопухов Л. Д. И. Менделеев и периодическая система элементов. Научно-популярный физико-математический журнал «Квант» № 5. 2019.
Эксперт: Кирилл Мартинсон, кандидат химических наук, старший научный сотрудник лаборатории материалов и процессов водородной энергетики Физико-технического института им. А. Ф. Иоффе






